氧化和还原反应之间的电压或电势差是由电池中还原和氧化反应的不同电化学势引起的。电化学势用于度量分子或元素的最外层电子在其两个价态平均能量之间的差异。(对于熟悉半导体理论的人来说,氧化和还原反应之间的电化学势差类似于二极管两侧之间的费米能级差)。由于电化学势是最外层电子能量的量度,因此对材料外层电子构型的检视将给出反应物和氧化还原产物之间电化学势的大小和符号。
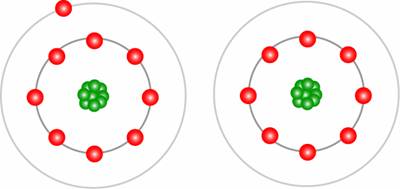
图:外层电子构型显示其最外层中有一个电子的元素。当它失去电子时,最外层变成八个电子,因此是稳定的低能构型。核心电子未显示。
材料的最低能量构型是其外层被电子完全占据。因此,外层中有一个电子的元素(例如锂,Li)将比失去此电子的元素具有更高的能量。因此在反应中:
Lithium Oxidation
金属锂比Li+具有更高的能量,氧化反应具有较大的正电化学势,值为3.04V。正号的定义是,如果电子被另一个反应使用,则反应会自发进行。
按照惯例,半反应(半反应是氧化或还原反应其中之一,即整个氧化还原反应的一半)被写为还原反应,因此上述反应通常写为:
Lithium Reduction
其具有负标准电位。对于所有半反应,改变反应方向会改变标准电势的符号,使得上述锂的还反应的标准电势为 E0 = -3.04 V.
类似地,相比于获得电子并因此具有完整外层的 Cl,外层中有 7 个电子的元素(例如 Cl)具有更高的电化学势。
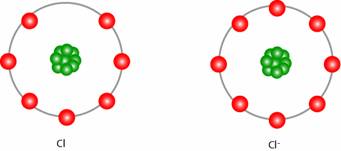
图:外电子构型显示其外壳中有七个电子的元素。当它得到一个电子时,外壳有八个电子,因此是稳定的低能构型。未显示核心电子。
因此,在反应中:
Chlorine Reduction
氯离子Cl-的能量比中性Cl低,其还原反应有很大的正电化学势,为1.36V。
助记工具:记住哪个反应发生在哪里以及做什么
有几种助记工具可以帮助记住电池中的术语。要记住还原反应和氧化反应之间的区别,您可以使用以下任何一种方法。第一种方法只是基于描述还原反应的词语。在还原反应中,价态被还原,这意味着它获得负电荷,即电子,因此电子必须是还原反应中的反应物。因此,“还原”这个词本身就标识了那里所发生的过程。关于氧化反应和还原反应的富有想象力的助记符是“LEO(狮子)GER(咆哮)”,其中LEO是“Loss of Electrons - Oxidation”的缩写,GER是“Gain of Electrons - Reduction”的缩写”。另一种方法是记住氧化反应和还原反应之间的区别(这不完全是可再生能源的精神),即“OIL RIG”:Oxidation Involves Loss of electrons, Reduction Involves Gain of electrons。
还有一些助记符可以帮助记住阳极发生的反应(氧化)和阴极发生的反应(还原)。“RED CAT 和 AN OX”将 REDduction 和 CAThode 的缩写组合在一起,并且将ANode 和 OXidation 的缩写。记住阳极和阴极发生哪些反应的另一种方法是注意字母“O”(代表氧化)出现在字母“R”(代表还原)之前,同样,字母“A”(代表阳极)出现在字母“C”(代表阴极)。因此,氧化发生在阳极,还原发生在阴极。最后,您可能还记得“阳极”和“氧化”都以元音开头,“阴极”和“还原”都以辅音开头。
最后要记住的信息是阳极为负,阴极是正。其助记符与阳极和阴极的助记符类似。阳极为负,阴极为正,“A”在“C”之前,“N”在“P”之前。 在电池中,情况稍微复杂一些,因为氧化和还原反应的物理位置在电池充电和放电时会发生变化。按照惯例,术语“阳极”和“阴极”是在电池放电时根据常规规则定义的,并且在电池充电时保留相同的名称。
